Le proprietà dell'acqua: isotopi e struttura molecolare.
Le proprietà dell'acqua 1: generale
Le proprietà dell'acqua 2: proprietà fisiche e chimiche
Composizione isotopica dell'acqua
L'acqua è una miscela di varie combinazioni di isotopi di ossigeno e idrogeno che differiscono tra loro per il numero di neutroni associati ai protoni nel nucleo.
1H,2 H (deuterio)3H (Tritium)
16O, 17O,18O.
I rapporti isotopici sono:
Per l'idrogeno:
2H/1H = 1 / 6900
3H/1H = 1 / 10 18
Il trizio è un elemento instabile, il suo tempo (tempo di dimezzamento) è anni 12,5.
Per l'ossigeno:
18O/16O = 1 / 500
17O/16O = 1 / 2500
4 principali specie molecolari e la loro frequenza è il seguente:
1H216O = 99,7%
1H2 18 O = 0,2%
1H217O = 0,04%
1HD16O = 0,03%
D216O = molto basso
Diversi isotopi inducono differenze nelle proprietà fisiche delle molecole, in particolare la loro densità, ma le proprietà chimiche rimangono gli stessi.
Acqua pesante D2O esiste nel suo stato naturale ma in molto
debole. Per averne una quantità apprezzabile è necessario padroneggiare le tecniche di separazione isotopica: questa è stata una delle sfide fondamentali durante l'ultima guerra mondiale per preparare l'arma atomica.
La composizione isotopica dei componenti chimici dell'acqua viene utilizzata nella stima di parametri termodinamici come la temperatura;
il rapporto 18 O/16O il ghiaccio delle calotte polari e l'acqua delle falde fossili forniscono informazioni sul clima del passato.
L'evaporazione dell'acqua oceanica avviene con frazionamento isotopico: l'isotopo leggero dell'ossigeno evapora di preferenza rispetto all'isotopo pesante. Gli oceani sono più ricchi di isotopi pesanti dell'acqua delle nuvole e delle precipitazioni.
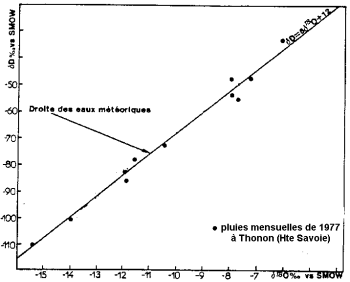
Contenuto isotopico stabile della precipitazione (da Blavoux e Letolle, 1995).
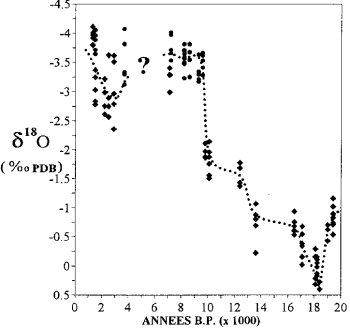
Variazione del contenuto di isotopi dell'ossigeno nei coralli a Mayotte (da Casanova et al., 1994).
Struttura della molecola
Gli atomi di idrogeno e ossigeno uniscono i loro elettroni per formare uno strato completo come quello del neon. In effetti, all'atomo di ossigeno mancano 2 elettroni per completare il suo guscio elettronico, sono i 2 atomi di idrogeno che lo forniscono. La molecola H2O formata è stabile.
Ossigeno: protoni 8 8 + neutroni
Idrogeno: 2 (2 * (1 1 neutroni protoni +))
Totale: protoni 10 10 bilanciando i carichi di elettroni.
I nuclei di idrogeno sono disposti su un lato dell'ossigeno per formare una caratteristica "testa di Topolino" (l'idrogeno sono le orecchie).
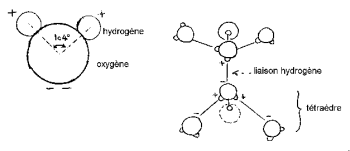
L'angolo HOH è 104,474 ° (caratteristico della geometria tetraedrica). La distanza tra l'ossigeno e l'atomo di idrogeno è prossima a 1 A ° (0,95718 A °) in vapore. Il diametro effettivo della molecola è dell'ordine di 2,82 A °.
Le cariche elettriche sono distribuite in modo non uniforme in questa piccola molecola. Gli elettroni sono attratti più fortemente dall'atomo di ossigeno che dall'atomo di idrogeno. Ci sono 2 centri di cariche positive vicino ai nuclei di idrogeno e 2 centri di cariche negative vicino al nucleo di ossigeno. Questo squilibrio nella distribuzione delle cariche, combinato con la geometria non lineare della molecola d'acqua, si manifesta nell'esistenza di un forte momento di dipolo elettrico. La molecola d'acqua è polare; si comporta come un dipolo elettrico che può così legarsi con altre molecole polari. Infatti, le molecole d'acqua possono essere inserite tra gli ioni costituenti di un cristallo dirigendo verso di essi la loro parte di carica elettrica opposta. L'attrazione degli ioni cristallini è notevolmente indebolita e la coesione del cristallo è ridotta, il che facilita la sua dissoluzione. Le proprietà polari della molecola d'acqua spiegano la tecnica del riscaldamento a microonde. Infatti, una molecola polarizzata si orienta rispetto a un campo elettrico; se questo varia, la molecola segue il cambiamento di orientamento. Da una certa frequenza, pochi GHz per l'acqua, i movimenti delle molecole producono calore per attrito. I forni domestici funzionano tipicamente a una frequenza di 2,45 GHz, che è UHF.
I 3 nuclei della molecola non sono stazionari, si muovono l'uno rispetto all'altro, la molecola vibra e si attorciglia. Nell'acqua liquida, le molecole tendono ad associarsi: le teste di Topolino legano l'orecchio al mento mediante legame a idrogeno. Infatti, degli 8 elettroni periferici dell'ossigeno, solo 4 sono coinvolti in legami covalenti con atomi di idrogeno. I restanti 4 elettroni sono raggruppati in 2 coppie chiamate doppietti di elettroni liberi. Ciascuno di questi doppietti caricati elettricamente negativamente può formare un legame elettrostatico con un atomo di idrogeno caricato positivamente di una molecola d'acqua vicina. Il legame idrogeno, stabile a temperatura ambiente, è tuttavia fragile rispetto al legame covalente. Nella molecola d'acqua la geometria formata dalla direzione dei 2 legami covalenti e dei 2 doppietti elettronici liberi è vicina a quella di un tetraedro il cui centro è occupato dai nuclei di ossigeno.
Tuttavia, la struttura su larga scala della molecola d'acqua è ancora imperfettamente conosciuta. Gli spettri di diffrazione dei raggi X e dei neutroni forniscono 2 valori principali: un segnale corrispondente a 1 A °, distanza tra i nuclei di idrogeno e ossigeno, e un valore da 2,84 a 4 A ° variabile a seconda della temperatura e corrispondente alla distanza tra 2 nuclei di ossigeno. La diffrattometria a raggi X consente inoltre di conoscere il numero medio di molecole per unità di volume di liquido situato ad una distanza R da una data molecola. Una molecola d'acqua ha una media di 4,4 vicini, il che suggerisce una maglia tetraedrica. Oltre alle molecole legate da legami idrogeno, ci sono altre molecole non legate, il che potrebbe spiegare perché il numero di molecole vicine è leggermente maggiore di 4 e non 4 esattamente come imporrebbe uno stato cristallizzato tetraedrico rigoroso. Il reticolo cristallino di molecole legate da legami idrogeno formerebbero cavità in cui sarebbero alloggiate le molecole non legate. Un'altra ipotesi si basa sulla distorsione dei legami idrogeno. Quest'ultimo, originariamente lineare, vale a dire con gli atomi O - HO allineati, potrebbe torcersi a vari livelli e consentire alle molecole più distanti delle vicine vicine di avvicinarsi alla molecola centrale.
Di recente sono stati sviluppati modelli teorici utilizzando potenti computer. Indicano che circa l'80% delle molecole d'acqua è coinvolto in 3 o 4 legami idrogeno; d'altra parte, escludono la presenza di molecole non legate. La modellazione al computer suggerisce che mentre l'acqua si raffredda, le reti di molecole assomigliano sempre più a esagoni simili a quelli nel ghiaccio.
Lo stato solido corrisponde a una disposizione cristallina più rigida. A pressione normale, il ghiaccio ha una struttura esagonale. A bassa temperatura (inferiore a -80 ° C) può assumere una struttura cubica. Le cariche elettriche possono muoversi nel reticolo cristallino e produrre difetti cristallini di tipo ionico: protone idrato H3O + e ione idrossile OH-. Il reticolo cristallino del ghiaccio non corrisponde al più compatto possibile impilamento di molecole. Alla fusione i difetti collassano perché i legami idrogeno si rompono e le molecole si avvicinano: la densità aumenta fino a un massimo a 4 ° C. Successivamente, in acqua liquida, l'aumento della temperatura allontana le molecole e la densità diminuisce.
Dettagli, riferimenti e bibliografia:
Blavoux B. e Letolle R. (1995) - Contributo di tecniche isotopiche alla conoscenza delle acque sotterranee. Geochronics, 54, p. 12-15.
Caro P. (1990) - Le proprietà fisiche e chimiche dell'acqua. Il grande libro dell'acqua, La Villette, p. 183-194.
Eagland D. (1990) - La struttura dell'acqua. La Recherche, 221, pag. 548-552.
Maidment DR (1992) - Manuale di idrogeologia. Mc Graw Hill.
Casanova J., Colonna M. e Djerroud K. (1994) - Geoprospective - paleoclimatology. Rapp. scient. BRGM, p. 76-79.

